ASAM AMINO
Asam amino merupakan komponen penyusun protein, setiap asam amino terdiri dari gugus karboksilat (-COOH) dan gugus amino serta yang membedakan asam amino satu dengan asam amino lainnya yaitu dengan adanya rantai samping (R). Sruktur umum asam amino seperti Gambar 1 berikut.

Gambar 1. Struktur umum asam amino.
Dari Gambar 1 telihat bahwa: Atom C pusat dinamai atom Cα ("C-alfa") sesuai dengan penamaan senyawa bergugus karboksil. Oleh karena gugus amina juga terikat pada atom Cα, senyawa tersebut merupakan asam α-amino. Asam amino biasanya diklasifikasikan berdasarkan sifat kimia dari masing-masing rantai samping penyusun asam amino. Hal ini karena adanya rantai samping dapat membuat asam amino bersifat asam lemah, basa lemah, hidrofilik jika polar, dan hidrofobik jika nonpolar.
STEREOISOMER ASAM AMINO
Stereoisomer merupakan suatu bentuk senyawa yang sama strukturnya dalam hal penataan ruang namun berbeda posisi unsur-unsur penyusunnya. Stereoisomer dibagi menjadi dua, yaitu enantiomer dan diastereomer.
Enantiomer merupakan isomer berupa bayangan cermin dari senyawa yang kiral dalam hal ini adalah asam amino kecuali glisin contohnya terlihat seperti Gambar 2. Karena atom C pusat mengikat empat gugus yang berbeda, maka asam amino—kecuali glisina memiliki isomer optik: l dan d. Cara sederhana untuk mengidentifikasi isomer ini dari gambaran dua dimensi adalah dengan "mendorong" atom H ke belakang pembaca (menjauhi pembaca). Jika searah putaran jarum jam (putaran ke kanan) terjadi urutan karboksil-residu-amina maka ini adalah tipe d. Jika urutan ini terjadi dengan arah putaran berlawanan jarum jam, maka itu adalah tipe l. Sedangkan diastereomer merupakan isomer yang bukan bayangan cermin dari suatu senyawa yang bersangkutan.

Gambar 2. Enantiomer L dan D
IKATAN PEPTIDA
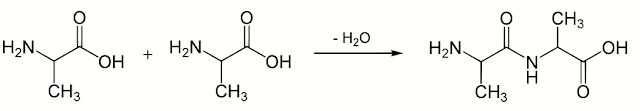
Ikatan peptida merupakan ikatan yang terjadi karena adanya penyambungan antar asam amino satu dengan asam amino lain untuk membentuk suatu rantai polimer protein. contohnya adalah sebagai berikut :
Protein merupakan polimer yang tersusun dari asam amino sebagai monomernya. Monomer-monomer ini tersambung dengan ikatan peptida, yang terikat antara gugus karboksil dengan gugus amina milik monomer di sebelahnya. Reaksi penyambungan ini secara alami terjadi di sitoplasma dengan bantuan ribosom dan tRNA. Pada polimerisasi asam amino, gugus -OH yang merupakan bagian gugus karboksil akan mengikat satu atom -H dari gugus amina dan kemudian terlepas membentuk air (H2O). Oleh sebab itu, reaksi ini termasuk dalam reaksi dehidrasi. Molekul asam amino yang telah melepaskan molekul air berada dalam bentuk residu asam amino.
ZWITTER-ION
Karena asam amino memiliki gugus aktif amina dan karboksil sekaligus, zat ini dapat dianggap sekaligus sebagai asam dan basa (walaupun pH alaminya biasanya dipengaruhi oleh gugus-R yang dimiliki). Pada pH tertentu yang disebut titik isolistrik, gugus amina pada asam amino menjadi bermuatan positif (terprotonasi, –NH3+), sedangkan gugus karboksilnya menjadi bermuatan negatif (terdeprotonasi, –COO-). Titik isolistrik ini spesifik bergantung pada jenis asam aminonya. Dalam keadaan demikian, asam amino tersebut dikatakan berbentuk zwitter-ion. Kebanyakan asam amino bebas berada dalam bentuk zwitter-ion pada pH netral maupun pH fisiologis yang dekat netral. Karena mempunyai muatan negatif dan positif, asam amino dapat mengalami reaksi terhadap asam maupun basa.

ZWITTER-ION
Karena asam amino memiliki gugus aktif amina dan karboksil sekaligus, zat ini dapat dianggap sekaligus sebagai asam dan basa (walaupun pH alaminya biasanya dipengaruhi oleh gugus-R yang dimiliki). Pada pH tertentu yang disebut titik isolistrik, gugus amina pada asam amino menjadi bermuatan positif (terprotonasi, –NH3+), sedangkan gugus karboksilnya menjadi bermuatan negatif (terdeprotonasi, –COO-). Titik isolistrik ini spesifik bergantung pada jenis asam aminonya. Dalam keadaan demikian, asam amino tersebut dikatakan berbentuk zwitter-ion. Kebanyakan asam amino bebas berada dalam bentuk zwitter-ion pada pH netral maupun pH fisiologis yang dekat netral. Karena mempunyai muatan negatif dan positif, asam amino dapat mengalami reaksi terhadap asam maupun basa.
Gambar 4. Bentuk Zwitter-ion asan amino
KLASIFIKASI ASAM AMINO
Yang saya pelajari dalam pengklasifikasian asam amino yaitu hanya terdapat 20 jenis asam amino berdasarkan perbedaan gugus rantai sampingnya. Namun berdasarkan informasi baru-baru ini telah terdapat 2 asam amino baru yang berhasil di ketahui. Tapi dalam pembahasan kali ini saya hanya akan menekankan pada ke-20 asam amino saja. Berikut daftar 20 asam amino mulai dari nama keseluruhan, singkatan tiga huruf, serta singkatan satu hurufnya.
Tabel 1. Daftar asam amino

Adapun pengelompokan berdasarkan perbedaan rantai sampingnya, asam amino dikelompokkan menjadi 5 kelompok, yaitu kelompok nonpolar alifatik, kelompok aromatik, kelompok bermuatan positif, kelompok bermuatan negatif, dan kelompok polar tak bermuatan. Berikut struktur kelima kelompok asam amino tersebut (Gambar 5):

Gambar 5. Pengelompokkan asam amino berdasarkan rantai samping penyusunnya.
SIFAT ASAM BASA ASAM AMINO
Karena asam amino dalam keadaan pH tertentu dapat berubah sifat keasaman dan kebasaannya maka pada keadaan tersebut kebasaan dan keasaman dari asam amino dapat ditentukan berdasarkan titrasi asam amino. Penjelasannya seperti pada Gambar 6 di bawah ini. Pada gambar tersebut terlihat bahwa titik isoelektrik terletak antara zwitter ion, dimana titik isoelektrik merupakan titik dimana terjadi kesetimbangan antara asam dan basa yang terdapat pada asam amino. Misal H+ =pKa1 dan OH- = pKa2 maka titik isoelektrik dilambangkan dengan pI yaitu :
pI = 0,5(pKa1+pKa2).
Gambar 6. Titrasi Asam amino
Keren Terimakasih ilmunya
ReplyDelete