Sebelumnya telah dibahas ciri-ciri asam dan basa pada bagian 1. Selanjutnya pada bagian ini akan dibahas mengenai:
1. Teori asam dan basa Arrhenius
2. Larutan asam dan basa dalam air
3. Derajat kekuatan asam dan basa
4. Dearajat keasaman (pH)
Teori Asam dan Basa Arrhenius
Pada pembahasan sebelumnya tentang Asam dan Basa Bagian 1 telah dibahas bahwa asam dan basa berada disekitar kehidupan manusia. Salah satu sifat asam selain rasanya asam juga dapat menyebabkan korosi pada logam kecuali emas serta menyebabkan kulit melepuh jika terkena asam kuat seperti asam sulfat dan asam klorida. Selain itu, basa memiliki sifat licin dan rasanya pahit. Basa juga bersifat korosif dan kaustik (merusak kulit).
Pada 1777, Lavoisier menyatakan bahwa oksigen adalah unsur utama Svante August Arrhenius (1859–1927) dalam senyawa asam. Pada 1808, Humphry Davy menemukan fenomena lain, yaitu HCl dalam air dapat bersifat asam, tetapi tidak mengandung oksigen. Fakta ini memicu Arrhenius untuk mengajukan teori asam basa. Menurut Arrhenius asam adalah zat yang dapat melepaskan ion H+ di dalam air sehingga konsentrasi ion H+ dalam air meningkat. Sedangkan basa adalah zat yang dapat melepaskan ion OH- di dalam air sehingga konsentrasi ion OH- dalam air meningkat.
Berdasarkan teori Arrhenius maka senyawa yang tergolong asam dan basa adalah sebagai berikut:
Senyawa asam yang terdiri dari HNO3, HCl dan H2SO4. Ketiga senyawa asam tersebut jika dilarutkan dalam air akan terbentuk ion H+ (ion hidrogen). Reaksinya sebagai berikut:
Menurut Arrhenius, produk akhir asam harus mengandung ion hidrogen (H+) dan produk akhir basa harus mengandung ion hidroksida (OH-).
Larutan Asam dan Basa
Pada
dasarnya air murni dapat terionisasi, namun dengan konsentrasi yang sangat
kecil, yaitu sekitar 10-7 M. Persamaan reaksi ionisasi air adalah
sebagai berikut:
Maka
tetapan kesetimbangan ionisasi air adalah:
Karena
air merupakan zat murni, maka berdasarkan konsep kesetimbangan konsentrasi air
tidak berubah atau sama dengan 1. Sehingga tetapannya menjadi:
Tetapan
kesetimbangan air lambangnya berubah dari Kc menjadi Kw
karena lambang w berasal dari kata water
dan K artinya tetapan kesetimbangan, jadi Kw adalah tetapan
kesetimbangan air.
Pada
25oC, nilai Kw = 10-14 dan pada 37oC
nilai Kw = 2,5 x 10-14 artinya ionisasi air bersifat
endoterm. Maka pada 25oC konsentrasi H+ sama dengan
konsentrasi OH-, sehingga:
Misal [H+] = [OH-] = C
KW = [H+][OH-]
10-14 = C x C
10-14 = C2
C = 10-7
Dengan demikian, [H+] = [OH-] = 10-7 pada 25oC. Jika dalam larutan terdapat konsentrasi [H+] = [OH-], maka larutan tersebut bersifat netral. Arrhenius menyimpulkan bahwa:
- Jika dalam larutan terdapat [H+] >> [OH-], maka larutan tersebut bersifat asam.
- Jika dalam larutan terdapat [H+] << [OH-], maka larutan tersebut bersifat basa.
- Jika dalam larutan terdapat [H+] = [OH-], maka larutan tersebut bersifat netral.
Untuk
mengidentifikasi suatu larutan bersifat asam, basa maupun netral maka dapat diuji
dengan menggunakan kertas lakmus. Kertas lakmus adalah suatu indikator
(petunjuk) yang dapat membedakan suatu zat/larutan bersifat asam, basa atau
netral. Hal ini disebabkan karena di dalam kertas lakmus terdapat senyawa
organik yang dapat berubah warna pada keadaan asam atau basa. Kertas lakmus
merah akan berubah menjadi biru jika dicelupkan ke dalam larutan basa.
Sedangkan kertas lakmus biru akan berubah menjadi merah jika dicelupkan ke
dalam larutan asam. Dan jika kertas lakmus (biru atau merah) dicelupkan ke
dalam larutan warnanya tetap (tidak berubah warna), arrtinya larutan tersebut
bersifat netral.
Tabel 1. Perubahan warna lakmus saat dicelupkan
ke dalam suatu larutan
|
Jenis larutan |
Lakmus merah |
Lakmus biru |
|
Asam |
Merah |
Merah |
|
Basa |
Biru |
Biru |
|
Netral |
Merah |
Biru |
Derajat Kekuatan Asam dan Basa
Suatu
larutan dapat digolongkan menjadi asam kuat, asam lemah, basa kuat dan basa
lemah. Suatu larutan dapat digolongkan sebagai asam kuat jika memiliki dayahantar listrik kuat dan nilai pH rendah atau pH < 3 (konsentrasi H+
tinggi). Sedangkan, jika daya hantar listrik rendah dan nilai pH antara 3 – 6,
maka larutan tersebut merupakan asam lemah.
Suatu
larutan digolongkan menjadi basa kuat, jika suatu larutan memiliki daya hantar
listrik tinggi dan pH tinggi atau pH > 11 (konsentrasi OH- sangat
tinggi). Sedangkan, larutan yang tergolong sebagai basa lemah jika larutan basa
tersebut memiliki daya hantar listrik rendah dan nilai pH sekitar 8 – 11.
Kuat
lemahnya suatu laturan asam dan basa salah satunya dipengaruhi oleh konsentrasi
asam atau basa tersebut yang dapat terionisasi di dalam air (pelarut).
Banyaknya zat yang terionisasi di dalam larutan disebut derajat ionisasi (α).
Nilai α dapat ditentukan dengan persamaan berikut:
Derajat ionisasi menyatakan kekuatan
relatif asam atau basa dalam suatu larutan dan dinyatakan dalam satuan persen (%).
Jika nilai derajat ionisasi mendekati 100%, maka larutan tersebut merupakan
larutan asam kuat atau basa kuat. Sedangkan jika nila derajat ionisasi <
20%, maka larutan tersebut disebut dengan larutan asam lemah atau basa lemah.
Hubungan asam kuat dan basa kuat dengan derajat ionisasi
Asam kuat dan basa kuat merupakan suatu
zat yang dalam larutannya dapat terionisasi sempurna serta memiliki derajat
ionisasi (α) mendekati 100%. Di dalam larutannya, suatu molekul asam kuat dan
basa kuat masing-masing molekulnya akan terurai menjadi ion H+
(untuk asam kuat) dan ion OH- (untuk basa kuat).
Contoh 1:
Tentukan konsentrasi ion-ion dalam larutan berikut:
a. HCl 0,1 M (asam kuat)
Jawab:
Jadi, karena HCl terionisasi sempurna (α
= 100%) maka [H+] = [HCl] = [Cl-] = 0,1M
b. Ca(OH)2 0,1 M (Basa kuat)
Jawab:
Karena Ca(OH)2 adalah basa kuat, maka seluruh Ca(OH)2 akan terurai sempurna menjadi ion-ionnya. Berdasarkan hasil perhitungan maka konsentrasi Ca(OH)2 = 0 karena terionisasi 100%, konsentrasi Ca2+ = 0,1 M, dan konsentrasi OH- = 0,2 M.
Hubungan asam lemah dan basa lemah dengan derajat ionisasi
Asam lemah dan basa lemah merupakan senyawa asam atau basa yang kelarutannya dalam air (pelarut) terionisasi sebagian atau sesuai dengan derajat ionisasinya. Asam lemah dan basa lemah di dalam larutannya dapat membentuk kesetimbangan antara molekul-molekul asam lemah dan basa lemah dengan ion-ionnya.
Kesetimbangan asam lemah
Jika asam lemah (HA) dilarutkan dalam
air, maka larutan tersebut akan terionisasi membentuk ion-ion H+ dan A-. Namun,
pada waktu bersamaan ion-ion tersebut akan bereaksi kembali membentuk HA sampai
terbentuk kesetimbangan. Berikut reaksi kesetimbangan dari asam lemah (HA):
Karena konsentrasi awal (HA) dianggap
tidak berubah atau konsentrasi HA yang terionisasi relatif kecil, maka akan
diperoleh nilai tetapan kesetimbangan ionisasi asam lemah (Ka)
sebagai berikut:
Nilai tetapan kesetimbangan ionisasi
asam lemah tidak bergantung pada konsentrasi awal asam lemah yang dilarutkan,
tetapi sangat bergantung pada suhu sistem. Jika nilai tetapan ionisasi asam
lemah adalah Ka, konsentrasi awal asam lemah (HA) adalah y M dan
karena HA merupakan asam monoprotik, maka [H+] = [A-],
sehingga:
Contoh:
Tentukan konsentrasi H+ yang
terdapat dalam CH3COOH 0,1 M (Ka
CH3COOH = 1,8 x 10-5)!
Jawab:
Sama halnya dengan asam lemah, basa
lemah juga terionisasi sebagian. Untuk menentukan [OH-] dalam
larutan basa lemah, maka kita dapat memisalkan basa lemah tersebut sebagai BOH,
sehingga reaksi ionisasinya sebagai berikut:
Karena konsentrasi awal basa lemah (BOH)
dianggap tidak berubah atau konsentrasi BOH yang terionisasi relatif kecil,
maka akan diperoleh nilai tetapan kesetimbangan ionisasi basa lemah (Kb)
sebagai berikut:
Jika nilai tetapan ionisasi basa lemah
adalah Kb, konsentrasi awal basa lemah (BOH) adalah y M dan karena
BOH merupakan basa monoprotik, maka [B+] = [OH-],
sehingga:
Contoh:
Tentukan konsentrasi OH- yang
terdapat dalam NH3 0,1 M (Kb NH3 = 1,8 x 10-5)!
Jawab:
Untuk melihat hubungan derajat ionisasi
dan tetapan ionisasi dapat dilihat dari persamaan berikut:
Dengan menggunakan perhitungan yang sama
dengan asam lemah, maka hubungan tetapan ionisasi basa lemah dan dengan derajat
ionisasinya adalah sebagai berikut:
Contoh:
Senyawa HF merupakan asam lemah. Jika 0,1
mol HF dilarutkan dalam 1 liter larutan dan diketahui konsentrasi H+
= 0,0084 M. Tentukan nilai Ka dan α?
Jawab:
Derajat Keasaman (pH)
Hal
yang perlu dipahami adalah bahwa konsentrasi H+ dan OH- hasil
ionisasi air sangatlah kecil oleh karena itu kita bisa mendefinisikannya dengan
menggunakan prinsip perhitungan logaritma. Untuk konsentrasi H+ digunakan
notasi pH, sedangkan untuk konsentrasi OH- digunakan notasi pOH.
pH
merupakan derajat keasaman suatu larutan. pH dalam larutan dapat didefinisikan
secara matematis sebagai negatif logaritma konsentrasi molar ion H+.
Sedangkan, pOH didefinisikan sebagai negatif logritma konsentrasi molar ion OH-.
Jika dirumuskan pH dan pOH adalah sebagai berikut:
Berdasarkan
definisi tersebut, pH dan pOH untuk air pada 25°C dapat dihitung sebagai
berikut:
Untuk penentuan pH asam dan basa akan dibahas pada bagian 3. Terima kasih, semoga bermanfaat.


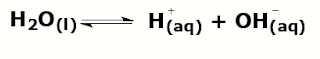






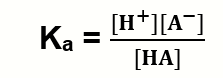


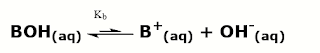




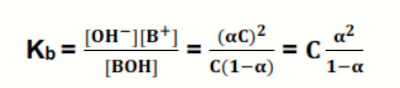






Comments
Post a Comment
Terima kasih sudah berkunjung. Semoga berkah.