STRUKTUR PRIMERStruktur primer merupakan
struktur protein paling sederhana. Struktur primer ditandai dengan urutan asam amino yang tersusun secara
linear dan tidak terjadi
percabangan rantai. Struktur primer terbentuk melalui ikatan antara
gugus α–amino dengan gugus α–karboksil. Ikatan tersebut dinamakan
ikatan peptida (Berg et al., 2006).
Struktur ini dapat menentukan urutan suatu asam amino dari suatu rantai polipeptida
(Voet & Judith, 2009). Struktur primer protein dengan urutan Tyr-Gly-Gly-Phe-Leu dapat dilihat pada Gambar 1.
Gambar 1. Struktur primer protein yang tersusun atas Tirosin (Tyr), Glisin (Gly), Glisin (Gly), Fenilalanin (Phe), dan Leusin (Leu)
STRUKTUR SEKUNDER
Struktur sekunder protein merupakan
kombinasi antara struktur primer yang distabilkan oleh ikatan kimia, salah satunya adalah ikatan hidrogen antara gugus karboksil dan gugus amina di sepanjang
tulang belakang polipeptida. Salah satu contoh struktur sekunder adalah
α-helix, β-pleated sheet dan turn. Struktur ini memiliki segmen-segmen
dalam polipeptida yang terlilit atau
terlipat secara berulang.
Struktur
α-helix
Struktur
α-helix terbentuk antara masing-masing atom oksigen karbonil pada suatu ikatan
peptida dengan hidrogen yang melekat ke gugus amida pada suatu ikatan peptida residu ke 4 asam amino di sepanjang rantai polipeptida Gambar 2. Adapun struktur tiga dimensi dari α-helix dapat dilihat pada Gambar 3.
Gambar 2. Skema ikatan hidrogen pada struktur α-helix.
Gambar 3. Strukur α-helix protein tiga dimensi
Beberapa sumber menyebutkan bahwa setiap pola ikatan hidrogen dalam berbagai tipe helix dinamai berbeda (Gambar 4), yaitu:
- Pola ikatan hidrogen 27 ribbon terjadi antara atom oksigen karbonil pada residu pertama yang terikat pada atom H dari gugus amida residu ke 2 atau atom atom H yang terikat pada N dengan nomor 6.
- Pola ikatan hidrogen 310 helix terjadi antara atom oksigen karbonil pada residu pertama yang terikat pada atom H dari gugus amida residu ke 3 atau atom atom H yang terikat pada N dengan nomor 9.
- Pola ikatan hidrogen α-helix terjadi antara atom oksigen karbonil pada residu pertama yang terikat pada atom H dari gugus amida residu ke 4 atau atom atom H yang terikat pada N dengan nomor 12.
- Pola ikatan hidrogen Π-helix terjadi antara atom oksigen karbonil pada residu pertama yang terikat pada atom H dari gugus amida residu ke 5 atau atom atom H yang terikat pada N dengan nomor 15.
Gambar 4. Pola ikatan hidrogen dalam berbagai tipe helix
Tidak semua polipeptida dapat membentuk α-helix. Adanya interaksi tambahan antar gugus samping asam amino dapat mempengaruhi kestabilan α-helix. Beberapa hal yang menyebabkan Tidak semua polipeptida dapat membentuk α-helix, yaitu:
- Polipeptida yang banyak memiliki residu bermuatan sejenis.
- Polipeptida yang memiliki gugus R besar seperti Ser, Thr, dan Leu.
- Dipol dielektrik dari ikatan peptida ditransmisikan sepanjang α-helix, sehingga secara keseluruhan α-helix adalah dipol.
Adanya dua residu bermuatan berlawanan pada jarak 3 residu dapat menstabilkan α-helix serta adanya gugus-gugus aromatik pada jarak 3 residu juga dapat menstabilkan α-helix. Adapun residu asam amino yang memiliki kecenderungan kuat untuk membentuk α-helix adalah Metionin, Alanin, Leusin, Asam Glutamat (tak bermuatan) dan Lisin (tak bermuatan).
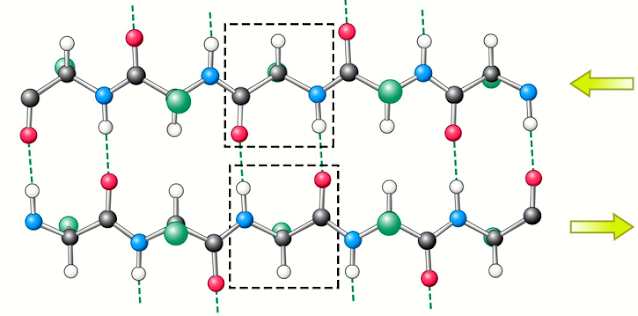
Struktur β-pleated sheet
Struktur sekunder β-pleated sheet terbentuk melalui ikatan hidrogen antara daerah linear rantai polipeptida. β-pleated sheet terdiri dari dua bentuk, yaitu antipararel dan pararel (Gambar 5 dan Gambar 6).
Gambar 5. Antiparalel β-pleated sheet
Gambar 6. Paralel β-pleated sheet
Gambar 7. Struktur 3D protein β-pleated sheet
Struktur β-pleated sheet paralel dan antiparalel berbeda dalam hal pola ikatan hidrogen. Pada bentuk konformasi antipararel memiliki konformasi ikatan sebesar 7 Å, sementara konformasi pada bentuk pararel lebih pendek yaitu 6,5 Å (Lehninger et al, 2004). Jika ikatan hidrogen ini dapat terbentuk antara dua rantai polipeptida yang terpisah atau antara dua daerah pada sebuah rantai tunggal yang melipat sendiri serta melibatkan empat struktur asam amino, maka dikenal dengan istilah β turn yang ditunjukkan dalam Gambar 8.

Gambar 8. Bentuk
konformasi β turn yang melibatkan empat residu asam amino
STRUKTUR TERSIER
Struktur tersier protein adalah lapisan yang tumpang tindih di atas pola struktur sekunder yang terdiri atas pemutarbalikan tak beraturan dari ikatan antara rantai samping berbagai asam amino (Gambar 9).
Gambar 9. Struktur tersier dari myoglobin
Struktur ini merupakan konformasi tiga dimensi yang mengacu pada hubungan spasial antar struktur sekunder. Struktur ini distabilkan oleh empat macam ikatan, yakni ikatan hidrogen, ikatan ionik, ikatan kovalen, dan ikatan hidrofobik. Dalam struktur ini, ikatan hidrofobik sangat penting bagi protein. Asam amino yang memiliki sifat hidrofobik akan berikatan di bagian dalam protein globuler yang tidak berikatan dengan air, sementara asam amino yang bersifat hodrofilik secara umum akan berada di sisi permukaan luar yang berikatan dengan air di sekelilingnya (Murray et al, 2009; Lehninger et al, 2004).
STRUKTUR KUARTENER
Struktur kuartener protein adalah gambaran dari pengaturan sub-unit atau promoter protein dalam ruang. Struktur ini memiliki dua atau lebih dari sub-unit protein dengan struktur tersier yang akan membentuk protein kompleks yang fungsional. Ikatan yang berperan dalam struktur ini adalah ikatan nonkovalen, yakni interaksi elektrostatis, hidrogen, dan hidrofobik. Protein dengan struktur kuarterner sering disebut juga dengan protein multimerik. Jika protein yang tersusun dari dua sub-unit disebut dengan protein dimerik dan jika tersusun dari empat sub-unit disebut dengan protein tetramerik (Gambar 10).
Gambar 10. Strukur kuartener hemoglobin manusia










Comments
Post a Comment
Terima kasih sudah berkunjung. Semoga berkah.